研究基于多价适配体和CHA扩增的智能手机荧光 / 比色双模适配体传感器用于沙门氏菌检测
沙门氏菌是一种主要的食源性病原体,对公众健康构成重大威胁,并造成重大经济负担。沙门氏菌的传统检测方法主要包括基于培养的技术、聚合酶链反应(PCR)和酶联免疫吸附试验(ELISA)。尽管这些方法因其可靠性和监管批准而被广泛使用,但它们也有明显的局限性。具体来说,基于培养的方法需要较长的潜伏期(通常是几天),而PCR涉及复杂的样品制备,ELISA往往表现出有限的灵敏度。这些限制激发了人们对能够提供快速有效检测的新型检测技术的极大兴趣。
适配体由于其易于合成和修饰、高稳定性和低成本等独特优势,已成为快速检测食源性病原体的有前途的生物识别元件。尽管基于适配体的食源性病原体检测方法取得了重大进展,但复杂食物基质中的性能下降仍然是阻碍其广泛实际应用的主要挑战。在识别元件方面,多价适体通过增强与靶标的结合亲和度来提高食品样品的灵敏度和抗干扰能力,是一种很有前景的策略。值得注意的是,基于DNA支架的多价适体结构由于其简单的制造、精确的控制和高度的可编程性而引起了相当大的兴趣。这些结构在病原体检测和食品样品分析中显示出显著的功效。
设计思路
在该检测系统中,基于四面体 DNA 纳米结构的多价适配体竞争探针被设计用于通过高亲和力识别目标细菌来实现初级信号放大,并释放大量 cDNA。释放的 cDNA 随后通过 CHA 介导的二次信号放大触发荧光和比色信号读出,从而在两种信号模式下实现灵敏的检测,并通过自身参考校正进行校准。
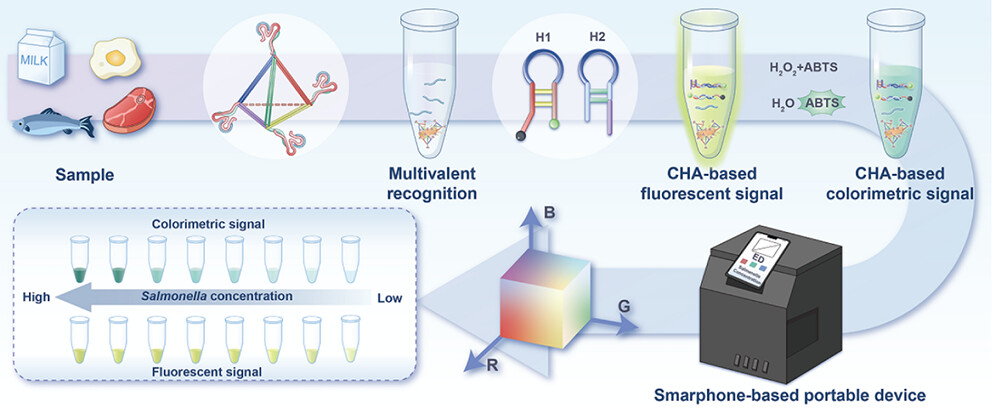
总图1. 基于智能手机的沙门氏菌荧光/比色双模适配体多价适配体和CHA扩增示意图。
研究过程
1. 多价适体竞争探针的合成与表征
通过琼脂糖凝胶电泳表征了四面体DNA纳米结构的自组装过程。如图1A所示,随着DNA单链(Lane 2-5)的加入,DNA结构的迁移逐渐减缓,表明形成了更高分子量的结构。特别是,四条单链的混合导致迁移速率的最大降低,证实了四面体DNA纳米结构的成功组装(Lane 5)。随后,通过延伸链将适配体和cDNA结合到四面体DNA纳米结构上,构建多价适配体竞争探针(图1B)。作者观察到,cDNA和适配体(Lane 4)的结合比cDNA (Lane 2)或适配体(Lane 3)表现出更慢的迁移速度,这表明dsDNA结构的成功形成。在将dsDNA掺入到四面体DNA纳米结构(Lane 5)后,观察到迁移率大幅下降,dsDNA带几乎无法检测到,证实了dsDNA成功附着到DNA四面体上形成多价竞争性探针。此外,为了进一步证实该探针的形成,进行了水动力直径和zeta电位的测量。如图1C所示,四面体DNA纳米结构的水动力直径约为22.3 nm。当适配体(多价适配体)和适配体- cdna(多价竞争探针)掺入后,其水动力直径逐渐增大至24.16 nm和25.65 nm,表明将适配体- cdna dsDNA附着在四面体DNA纳米结构上可以大大增加其水动力直径。同样,与适配体和适配体cdna杂交后,zeta电位也从−31.8 mV增加到−38.7 mV和−40.1 mV(图1D)。总的来说,这些结果证实了多价竞争性探针的成功制造。
多价竞争性探针的主要功能是识别具有高结合亲和力的目标细菌,随后释放大量竞争性DNA片段(cDNA)以进一步扩增信号。四面体DNA多价适体对目标沙门氏菌的结合性增强已在作者先前发表的工作中得到证实。在此,作者使用荧光显微镜进一步评估了多价适体竞争探针增强的结合亲和度。多价和单价适配体竞争探针,在适配体的5’端用荧光素(5’-FAM)标记,与沙门氏菌孵育。如图1E所示,用多价竞争性探针标记的沙门氏菌比用同等浓度的单价竞争性探针处理的沙门氏菌表现出明显更高的荧光强度,这表明多价竞争性探针具有更强的结合能力。此外,竞争性相互作用也通过天然聚丙烯酰胺凝胶电泳(PAGE)进行了评估。如图1F所示,lane 2-3分别代表cDNA、多价竞争探针和沙门氏菌,其中多价竞争探针和目标细菌由于体积较大,一直留在样品进口中没有迁移。在细菌中加入单价适体竞争探针(Lane 5)或多价适体竞争探针(Lane 4)后,在Lane 4和Lane 5上都出现了cDNA条带,表明细菌的识别可以从适体中释放cDNA。此外,cDNA在Lane 4中的条带明显比Lane 5中的条带亮,表明多价适体竞争探针具有更高的结合亲和度,可以实现有效的信号放大。
图 1. 多价适配体竞争探针的合成与表征。(A)四面体DNA纳米结构组装的琼脂糖凝胶电泳结果:Lane 1:标记;通道2-5:S1, S1 + S2, S1 + S2 + S3, S1 + S2 + S3 + S4(四面体DNA纳米结构)。(B)多价适配体竞争探针组装的琼脂糖凝胶电泳结果:Lane 1: marker;Lane 2-6: cDNA,适配体,适配体-cDNA,四面体DNA纳米结构,多价适配体竞争探针。(C)四面体DNA纳米结构、四面体多价适配体和多价适配体竞争探针的尺寸电位分布。(D)四面体DNA纳米结构、四面体多价适配体和多价适配体竞争探针的Zeta电位分布。(E)荧光显微镜下四面体多价与单价适配体竞争探针结合能力的比较,比尺:2 μm。(F)竞争相互作用的多价适配体竞争探针PAGE结果:Lane 1: marker;Lane 2:cDNA;Lane 3:多价适配体竞争探针;Lane 4:沙门氏菌;Lane 5:多价适配体竞争探针+沙门氏菌;Lane 6:单价适配体竞争探针+沙门氏菌。
2. 双模催化发夹组件的验证
为了考察CHA反应的可行性,进行了天然聚丙烯酰胺凝胶电泳实验。如图2A所示,Lane 6-8分别表示发夹链H2、H1和cDNA。当cDNA与H1混合时,在Lane 5上观察到一个新的条带,对应于cDNA/H1异双工,迁移速度较慢。相比之下,cDNA与H2混合(Lane 4)和H1与H2混合(Lane 3)仍有两条独立条带,未观察到杂交条带,说明没有CHA泄漏,检测本底较低。最终,在cDNA存在的情况下,观察到与H1/H2异双工相对应的最慢杂交带(Lane 2),表明CHA过程成功启动。
在作者的设计中,CHA的电导率可以产生荧光/比色双信号读出。因此,测定了CHA过程中的荧光强度和比色强度。在荧光信号方面(图2B), H1和H1+H2都表现出微弱的荧光强度,这是由于H1的发夹构型中淬灭剂BHQ1淬灭了荧光团(FAM)。与cDNA杂交后,H1显示出明显的荧光恢复,表明H1打开,荧光团(FAM)与猝灭者(BHQ1)分离。当cDNA与H1和H2混合后,荧光强度显著增加,这是由于CHA的高效信号扩增。在比色信号方面(图2C), H2、H1+H2和cDNA+H2在650 nm处的吸光度可以忽略,这表明富含g的序列被阻断在H2发夹结构中,使其无法具有过氧化物酶样活性。然而,在cDNA启动后,比色信号得到极大改善,因为H1/H2异双工的形成释放了富含g的序列,形成具有高过氧化物酶活性的g -四重结构,随后产生绿色读数。利用圆二色性(CD)光谱进一步证实了g -四相结构的形成。如图2D所示,活化CHA反应的产物显示出g -四plex的特征CD谱,在约265 nm处有一个主要的正峰,在240 nm处有一个显著的负峰,表明g -四plex结构的形成。而失活后的cDNA、H2和H1+H2均未出现CD峰,表明未形成g -四重结构。这一结果直接证明了g -四相结构的形成。以上结果证明了荧光/比色双模CHA信号放大系统的可行性。
最后,将双模CHA信号放大系统与多价竞争探针结合用于沙门氏菌检测,进一步验证了该系统的可行性。如图2E所示,多价适体竞争探针与H1和H2的混合物没有产生新的条带(Lane 8),表明单独的多价适体竞争探针无法启动CHA。然而,在引入目标菌(Lane 9)后,出现了与CHA产物(Lane 5)相同的新条带,这表明添加目标菌可以有效激活CHA过程。此外,还测量了沙门氏菌存在时的荧光强度和比色强度。如图2F所示,在没有沙门氏菌的情况下观察到可以忽略不计的信号。相比之下,在引入靶标后,检测到大量的信号增强。为了进一步确认多价效应的信号放大效应,作者精确地制作了从一价到四价的适配体制备的竞争性探针,并将其用于检测。正如作者所看到的,随着价的上升,荧光和比色强度逐渐增加。值得注意的是,与单价适配体相比,四价竞争性探针的荧光强度提高了约2.2倍,比色强度提高了3.5倍。结果表明,该方法通过多价和CHA双轮信号放大,实现了沙门氏菌的灵敏检测。

图 2. 验证双模CHA系统的可行性。(A) CHA产物天然聚丙烯酰胺凝胶结果:Lane 1:标记物,Lane 8:引发剂(cDNA);Lane 7: H1;Lane 6:H2;Lane 5: cDNA+H1;Lane 4: cDNA+H2;Lane 3:H1+H2;Lane 2:cDNA + H1 + H2。CHA扩增(cDNA: 1 μM; H1: 2 μM; H2: 1.5 μM)的荧光信号(B)和比色信号(C)。(D) CHA产物的圆二色光谱。(E)天然聚丙烯酰胺凝胶沙门氏菌检测结果:Lane 1: marker;Lane 2:cDNA;Lane 3:H1;Lane 4:H2;Lane 5:CHA;Lane 6:多价适体竞争探针;Lane 7:多价适体竞争探针检测沙门氏菌;Lane 8:多价适体竞争探针+ H1 + H2;Lane 9:单价适体竞争探针检测沙门氏菌+ H1 +H2。(F)多价信号放大效果评价。
3. 检测灵敏度
为了提高多价竞争探针和基于催化发夹组装(CHA)的沙门氏菌检测方法的性能,对几个关键实验参数进行了系统的评价和优化。确定了最佳条件:四面体DNA纳米结构与适体的比例为1:4.5,H1和H2的浓度均为1.5 μM, CHA反应条件为25 ℃ 孵育30 min(图S2)。在最佳条件下,研究了基于多价竞争探针集成荧光/比色双模cha法检测沙门氏菌的性能。以PBS缓冲液作为空白对照,记录不同沙门氏菌浓度下的荧光和比色信号强度。如图3A、B所示,随着沙门氏菌浓度从10 CFU/mL增加到107 CFU/mL,荧光强度和比色强度逐渐增加。实验结果表明,比色信号与沙门氏菌浓度成正比关系,回归方程为y1 = 0.0368x + 0.0898 (R2= 0.9891),其中x为沙门氏菌浓度的对数,y1为比色强度。计算出比色法的检出限(LOD)为28 CFU/mL,定义为D = 3N/S(其中N和S分别表示空白值的标准差和标准曲线的斜率)。荧光信号灵敏度更高,线性回归方程为y2 = 1E6x + 787366(其中x为沙门氏菌浓度的对数,y2为荧光强度),LOD为10 CFU/mL。结果表明,该双模检测系统具有较宽的检测范围和较低的lod,适用于沙门氏菌的灵敏定量检测。此外,通过将PBS中获得的结果与加入不同浓度沙门氏菌的鸡肉、鳕鱼、蛋清和牛奶样品的结果进行比较,评估了该方法在不同复杂食品基质中的稳健性和弹性。
图 3. 多价适体竞争探针辅助CHA法检测沙门氏菌(10 ~ 107 CFU/mL)。比色检测(A)和荧光检测(B)结果。多价适体竞争探针辅助CHA法比色检测(C)和荧光检测(D)的特异性。
4. 试验的特异性
为了评估该方法的特异性,在106 CFU/mL的浓度下,将沙门氏菌与其他六种常见致病菌(包括金黄色葡萄球菌、副溶血性弧菌、大肠杆菌O157:H7、单核增生李斯特菌、溶藻弧菌和volnificus弧菌)一起进行了检测。如图3C,D所示,非目标菌的比色和荧光信号保持在与对照相当的水平,干扰可以忽略不计,而目标沙门氏菌的荧光和比色信号明显放大,远高于非目标菌。此外,含有所有细菌的混合物显示出与单独沙门氏菌相似的信号强度。这些发现证实了沙门氏菌检测系统的特殊特异性,归因于多价适体设计提供的增强的结合特异性。
5. 基于智能手机的便携式设备的制造与可行性
为了提高现场检测的便捷性,构建了一种基于智能手机的便携式荧光和比色信号检测装置。该检测设备采用3D打印技术设计为紧凑的暗室,并配备内置白色和紫外线光源,以确保智能手机成像的最佳照明。检测装置的三维设计和实际物理图像如图4A、B所示。在装置内部,一个495nm的紫外灯被巧妙地放置在左下方的壁上,以方便荧光信号的读取,而一个白炽灯被安装在左上方的壁上,以提供准确的比色读出所需的最佳光强度。为了增强光反射并创造一个均匀的照明环境,设备的其余三面墙都安装了镜面纸。在底部面板上,八个夹子在中心对齐,为样品放置提供固定和一致的区域,确保准确和可重复的图像捕获。在盒子的顶部,有一个用于智能手机相机成像的专用光圈,以及一个小观察窗口,允许方便的裸眼评估检测结果。为了便于对照片结果进行分析,作者开发了一个名为“SalmoDetect RGB”的定制微信小程序,可以将图像数据自动转换为相应的沙门氏菌浓度。为了精确量化,对每个检测管内的颜色分布进行建模,并从捕获的图像中精心选择五个代表性点,以准确地代表整个样本(图4C)。小程序自动从这些点提取颜色值,然后用于定量沙门氏菌浓度。为了提高检测的准确性,计算了RGB、HSV和CMYK等各种颜色模式及其欧几里得距离(ED)的值,以评估信号强度的变化。如图S5A、B、表S4和表S5所示,在荧光和比色信号输出中,ED(RGB)值与沙门氏菌浓度的敏感性和相关性均较高。

图 4. 基于智能手机的便携式设备的制造与可行性评估。(A)检测装置三维设计图。(B)设备的物理图像。(C)检测管内颜色分布建模,说明五个代表性样本点的选取。(D)通过定制小程序生成的荧光和比色检测标准曲线。(E)使用基于智能手机的便携式设备对沙门氏菌进行样本分析和定量。(F)沙门氏菌荧光和比色测定的相关性。每个数据点代表三个重复的平均值,应用线性回归推导相关曲线。
6. 食物样本中沙门氏菌的检测
为了验证建立的基于智能手机的便携式设备的性能,对四种具有代表性的食品样品(鸡肉,鳕鱼,鸡蛋和牛奶)进行了沙门氏菌检测,结果如图5A,B所示。荧光和比色结果的ED(RGB)值均随鼠伤寒沙门氏菌浓度的升高而成比例升高。此外,为了评估该传感平台的实用性,对添加了三种不同浓度沙门氏菌的鸡肉、鳕鱼、鸡蛋和牛奶进行了回收实验。如表S6和S7所示,比色信号的平均回收率为80.9% ~ 112%,荧光信号的平均回收率为86% ~ 113%。这些结果表明,该方法在应用于实际样本时具有鲁棒性和可靠性。为了进一步评估基于智能手机的传感平台的性能,使用微孔板读取器或基于智能手机的双模荧光/比色感应传感器和平板计数方法分析了40个盲标样品(鸡肉、鳕鱼、鸡蛋和牛奶各10个样品)(图5C)。在40份检测样品中,4号和9号鸡肉、12号、13号和17号鳕鱼、23号和28号牛奶和38号鸡蛋样品均检测出沙门氏菌阳性。与平板计数法的高度一致性表明该双模荧光/比色适体传感器在实际样品分析中的高可靠性。进一步,对基于智能手机的双模检测方法与平板计数法、基于微孔板阅读器的双模检测方法进行相关性分析。均获得Pearson相关系数|r| >0.8,显示出较强的正线性关系,证实了智能手机集成双模传感平台具有良好的准确性、可靠性和实用性。此外,该研究表明,与传统实验室方法相比,该研究具有显著的成本效益优势。

图 5. 食物样本中沙门氏菌的检测。(A)含沙门氏菌食品样品荧光检测ED(RGB)值的线性回归。(B)含沙门氏菌食品样品比色检测ED(RGB)值的线性回归。(C)四种食品样品(编号1-10:鸡肉样品;编号11-20: cod样品;编号21-30:牛奶样品;编号31-40:鸡蛋样品)的鼠伤寒沙门氏菌荧光、比色和平板计数检测热图比较,样品的CFU/g或CFU/mL。
结论
综上所述,作者通过巧妙地将多价适体竞争测定法与 CHA 相结合,开发了一种基于智能手机的双模式荧光和比色检测系统,用于检测沙门氏菌。该方法灵敏度的提高主要源于双重信号放大策略,该策略利用了适体的多价高结合亲和力以及在荧光和比色模式下由催化发夹组装(CHA)介导的放大作用。这种双重放大不仅增强了检测信号,还确保了沙门氏菌的可靠定量。同时,荧光和比色双模式检测方法包含了内置的交叉验证,确保了结果的高准确性。该方法具有灵敏度和成本效益方面的优势,也展示了一定的普遍适用性。
来源:TanC-Group
